Makalah Eksperimen Frank-Hertz
Nhingz, BLOG--Menjalani kulyah fisika inti, kebetulan berjumpa dengan salah seorang dosen yang jarang masuk ruangan. So, setiap kali dia tidak masuk kami diberi tugas untuk mengerjakan makalah individu, kali tentang Eksperimen Frank dan Hertz... Nah, sebelum dikumpul, baiknya aku share duluwww, semoga bermanfaat yah!!! :) :( :)
BAB
I
PENDAHULUAN
A.
Latar Belakang
Leukipos
dan Demokritos dua ilmuan yang mengembangkan konsep atom. Mereka menyatakan
bahwa atom bagian terkecil suatu zat/partikal yang tidak dapat dibagi lagi.
Konsep ini bertahan hingga abad XIX. Pada akhir abad ke XIX banyak ilmuan yang
berusaha mengungkap rahasia atom (Usuludin, 1999) .
Teori
atom Bohr memperkenalkan atom sebagai sejenis miniatur planet mengitari
matahari, dengan elektron-elektron mengelilingi orbitnya sekitar bagian pokok,
tapi dengan perbedaan yang sangat penting. Bilamana hukum-hukum fisika klasik
mengatakan tentang perputaran orbit dalam segala ukuran, Bohr membuktikan bahwa
elektron-elektron dalam sebuah atom hanya dapat berputar dalam orbitnya dalam
ukuran spesifik tertentu. Atau dalam kalimat rumus lain: elektron-elektron yang
mengitari bagian pokok berada pada tingkat energi (kulit) tertententu tanpa
menyerap atau memancarkan energi. Elektron dapat berpindah dari lapisan dalam
ke lapisan luar jika menyerap energi. Sebaliknya, elektron akan berpindah dari
lapisan luar ke lapisan lebih dalam dengan memancarkan energi.
Kemampuan teori Bohr yang
menjelaskan spektrum dari hydrogen atom, yakni telah diketahui bahwa gas hidrogen
jika dipanaskan pada tingkat kepanasan tinggi, akan mengeluarkan cahaya dari
suatu frekuensi tertentu. Nilai terbesar teori Bohr tentang atom dari hipotesa
sederhana tapi sanggup menjelaskan dengan ketetapan yang mengagumkan tentang
gelombang panjang yang persis dari semua garis spektral (warna) yang
dikeluarkan oleh hidrogen
Tetapi teori Niels Bohr terdapat kekurangan dan harus
diganti secara mekanika kuantum, agar ketelitian dan kegunaannya lebih
besar. Berdasarkan permasalahan inilah,
pada tahun 1914 ilmuwan bernama James Franck dan Gustav Hertz melakukan
sederetan eksperimen yang membuktikan kebenaran teori Bohr yakni juga mengenai
kehadiran eksitasi atom.
B. Rumusan Masalah
Rumusan masalah dalam pembuatan makalah ini adalah:
1. Jelaskan
Deskripsi Eksperimen Frank dan Hertz?
2. Jelaskan
Proses Eksperimen Frank dan Hertz?
C.
Tujuan
Tujuan
dari pembuatan makalah ini adalah:
1. Mengetahui
Deskripsi Eksperimen Frank dan Hertz.
2. Mengetahui
proses Eksperimen Frank dan Hertz.
BAB II
PEMBAHASAN
A. Deskripsi
Sebuah atom dapat mengeksitasi
ke tingkat energi di atas tingkat energi dasar yang menyebabkan atom tersebut
memancarkan radiasi melalui dua cara. Salah satunya adalah tumbukan dengan
partikel lain. Pada saat tumbukan, sebagian dari energi kinetik pada partikel
akan diserap oleh atom. Atom yang tereksitasi dengan cara ini akan kembali ke
tingkat dasar dalam waktu rata-rata 10-8 detik dengan memancarkan
satu foton atau lebih. Cara lainnya adalah dengan lecutan listrik dalam gas
bertekanan rendah, sehingga timbul medan listrik yang mempercepat elektron dan
ion atomic sampai energi kinetiknya cukup untuk mengeksitasi atom ketika
terjadi tumbukan. Misalnya pada lampu neon dan uap air raksa, medan listrik
kuat yang terpasang antara elektroda dalam tabung berisi gas menimbulkan emisi
radiasi spektral karakteristik dari gas itu yang ternyata merupakan cahaya
berwarna kemerah-merahan (dalam kasus neon) dan cahaya kebiru-biruan (dalam
kasus uap air raksa) dalam percobaan ini menggunakan uap air raksa sebagai
media.
Mekanisme eksitasi yang berbeda
terpaut jika sebuh atom menyerap sebuah atom cahaya yang energinya cukup untuk
menaikkan atom tersebut ke tingkat energi yang lebih tinggi. Jika cahaya putih
yang mengandung semua panjang gelombang dilewatkan melalui gas hydrogen, foton
dengan panjang gelombang yang bersesuaian dengan transisi antara tingkat energi
yang bersangkutan akan diserap. Atom hidrogen yang tereksitasi yang
ditimbulkannya akan memancarkan kembali energi yang eksitasinya hampir saat itu
juga, tetapi foton keluar dalam arah yang rambang dengan hanya beberapa daya
yang berarah sama dengan berkas semula dari cahaya putih tersebut. Jadi garis
gelap dalam spektrum absorbsi tidak 100% hitam dan hanya terlihat hitam karena
terjadi kontras dengan latar belakang yang terang. Garis yang seharusnya dalam
spektrum absorbsi setiap unsur bersesuaian dengan garis pada spektrum emisi
yang menyatakan transisi ke tingkat dasar yang cocok dengan hasil eksperimen
(Beisser, 1992).
B.
Eksperimen
Frank dan Hertz
Pada tahun 1914 James Frank dan
Gustav Hertz melaporkan energi yang hilang akibat elektron yang melewati uap
mercury, dan adanya pancaran sinar ultraviolet dengan panjang gelombang 254 nm.
Kemudian percobaan Frank-Hertz ini dijadikan percobaan klasik untuk
menjelaskaan teori kuantum (Leyboed, internet).
Gambaran sederhana mengenai
percobaan ini adalah sebagai berikut:
”Dalam tabung elektron-elektron meninggalkan katoda
karena dipanasi dengan sebuah filamen pemanas, semua elektron kemudiaan
dipercepat menuju sebuah kisi oleh beda potensial yang diatur. Apabila energi
elektron lebih besar dari pada Vo, yaitu tegangan perlambat kecil
antara kisi dan plat katoda maka elektron dengan energi V eV (elekron volt) dapat menembus kisi dan jatuh pada plat
anoda. Arus elektron yang mencapai plat anoda tersebut dapat diukur menggunakan
ampermeter. Semakin banyak elektron yang mencapai anoda maka arus listriknya
akan lebih besar. Atom-atom dalam tabung saling bertumbukan akan tetapi tidak
ada energi yang dilepaskan dalam tumbukan ini. Jadi tumbukannya secara elastis sempurna.
Dan untuk menghasilkan terjadinya pelepasan energi, maka atom mengalami
transisi kesuatu keadaan eksitasi dan hal ini dapat dilakukan dengan cara
tabung elektron diisi dengan gas hidrogen, maka elektron akan mengalami
tumbukkan dan juga jika tegangan V dinaikkan lagi maka arus listriknya juga
akan ikut naik”.
Pada percobaan ini menggunakan
atom mercury atau raksa atau Hidrargium (80Hg200,6)
mempunyai sifat-sifat fisis sebagai berikut :
1.Bersifat
cair dan berwarna putih keperakan
2.Nonkunduktor
3.Logam
yang tidak dapat ditempa
4.Tidak
mengkilap
5.Titik
didih pada 630 oK
6.Titik
lebur pada 234 oK
Hydragyrum atau raksa mempunyai konfigurasi sebagai berikut :
1s 2s
2p 3s 3p
3d 4s 4p
4d 4f 5s
5p 5d 5f 6
Diagram tingkat-tingkat energi
untuk air raksa. Dalam masing-masing tingkat eksitasi satu elektron terluar
berada dalam keadaan dasar, dan pelambangan tingkat energi dalam diagram
bersesuaian dengan elektron terluar (Beiser,1987).
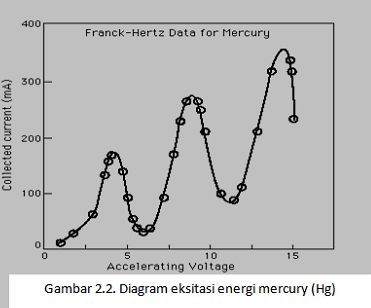
Frank dan Hertz menembaki uap
berbagai unsur dengan elektron yang energinya diketahui dengan memakai alat
seperti yang terlihat pada gambar 2.1. perbedaan potensial kecil Vo
dipasang diantara kisi dan keping pengumpul, sehingga setiap elektron yang
mempunyai energi lebih besar dari harga minimum tertentu memberi kontribusi
(sumbangan) pada arus i yang melalui ammeter. Ketika potensial pemercepat V
bertambah, elektron yang datang pada keping bertambah banyak dan arus i naik
(Gambar 2.2). Sehingga atom-atom dalam tabung saling bertumbukan akan tetapi
tidak ada energi yang dilepaskan dalam tumbukan ini. Jadi tumbukannya secara
elastis sempurna.
Lebih
jelasnya lihat gambar 2.3.
Percobaan akan siap jika
rangkaian terlebih dahulu sudah di set dan pipa lampu akan semakin panas dan
temperatur oven juga akan sampai kira-kira 175° C dan memulai tegangan pada
anoda untuk 0 V serta membuat Elektrometer Keithleuy yang skalanya harus diperhitungkan,
lalu tegangan diturunkan sedikit demi
sedikit sampai kita mendapatkan sinyal yang pasti pada elektrometer lalu catat
tegangannya setelah itu tegangan anoda itu juga dinaikkan perlahan-lahan (
kenaikkan anoda maksimum 30 V ) maka elektrometer itu akan menangkap
perubahannya secara lambat karena untuk memberikan waktu kepada reaksinya dan
arus yang dipakai dari minimum sampai maksimum lalu catat tegangan yang
disesuaikan dengan arusnya.
Percobaan Frank-Hertz adalah suatu
eksperimen untuk menguji hipotesis Bohr. Neils Bohr telah mengembangkan
kekurangan dari teori yang dikemukakan oleh Rutherford pada tahun 1913 melalui
percobaannya tentang spektrum atom hidrogen.
Penjelasan Bohr tentang atom
hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori
kuantum dari Planck yang diungkapkan dalam 4 postulat, yaitu:
a.
Hanya ada seperangkat orbit tertentu
yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal
sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan
melingkar disekeliling inti.
b.
Selama elektron berada dalam
lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam
bentuk radiasi yang dipancarkan maupun diserap.
c.
Elektron hanya dapat berpindah dari
satu lintasan stasioner ke satu lintasan stasioner lain. Pada peralihan ini,
sejumlah energi tertentu terlibat yang besarnya sesuai dengan persamaan ΔE=hυ
d.
Lintasan elektron yang dibolehkan
memiliki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut
momentum sudut.
Dengan demikian, stuktur atom
berdasarkan model atom Bohr adalah elektron dapat berada di dalam
lintasan-lintasan stasioner dengan energi tertentu. Dimana lintasan elektron
dapat juga dianggap sebagai tingkat energi elektron. Meskipun model atom Bohr
dapat menjelaskan kestabilan atom dan spektrum garis atom hidrogen, model atom
Bohr tidak dapat digunakan untuk menentukan spektrum atom berelektron banyak.
Jadi model atom Bohr tersebut memiliki kelebihan dapat menjelaskan bahwa atom
terdiri dari beberapa kulit untuk tempat berpindahnya elektron. Sedangkan
kelemahannya adalah tidak dapat menjelaskan efek zeeman dan efek strack.
BAB III
PENUTUP
A.
Kesimpulan
·
Percobaan Frank-Hertz adalah suatu
eksperimen untuk menguji hipotesis Bohr. Dimana, Neils Bohr telah mengembangkan
kekurangan dari teori yang dikemukakan oleh Rutherford pada tahun 1913 melalui
percobaannya tentang spektrum atom hidrogen.
·
Percobaan Frank-Hertz mengggunakan
sinar elektron yang dipercepat untuk mengukur besarnya energi eksitasi pertama
pada atom gas mercury (Hg). Elektron yang dihasilkan dari proses termionik pada
katoda akan dipercepat diantara katoda dan anoda, dalam tabung uap-Hg elektron
tersebut akan mengalami tumbukan dengan atom hidrogen. Proses tumbukan yang
terjadi meliputi tumbukan elstik dan non elastik.
B.
Saran
Saya
sadar dalam penyusunan makalah ini masih sangat jauh dari kesempurnaan,
maka dari itu saran dan bimbingan dari
para bapak ibu dosen selaku pembina, saya harapkan demi kesempurnaan karya
penulis selanjutnya
DAFTAR PUSTAKA
Beiser, Arthur. 1987. Konsep Fisika Modern. Jakarta:
Erlangga..
Krane, Kenneth. 1992. Fisika Modern. Jakarta: Universitas
Indonesia.
Usuludin.1999. Fisika.Klaten:Intan Pariwara.



0 comments:
Posting Komentar